COMPUESTOS INORGÁNICOS EN LA VIDA DIARIA
ÁREA: QUÍMICA
INTRODUCCIÓN:
QUE SON LOS COMPUESTOS INORGÁNICOS:
Y a instancias de la Química, inorgánico, es aquel compuesto mineral en el cual el carbono no resulta ser el elemento integrante fundamental, mientras que el agua sí resulta ser el más abundante.
A diferencia de lo que sucede con los compuestos de tipo orgánicos el compuesto inorgánico se forma de modo ordinario como consecuencia de la intervención de varios fenómenos físicos y químicos, tal es el caso de la electrólisis y la fusión, aunque también la energía solar, el agua y el oxígeno pueden ser el puntapié de la creación de un compuesto inorgánico.
Los compuestos inorgánicos están compuestos por enlaces los cuales podrán ser covalentes (compartimento de electrones entre dos o más átomos), o en su defecto, iónicos (unión que es resultado de la atracción de iones que ostentan diferente signo, electropositivo y electronegativo).
En tanto, los compuestos inorgánicos presentan una gran variedad de estructuras y entonces dependiendo del los átomos que los componen es que se los puede clasificar en las siguientes categorías: monoatómicas (disponen de un solo átomo tal es el caso de las moléculas de gases nobles), diatómicas (constan de dos átomos), triatómicas (presentan tres átomos, tal es el caso de las moléculas del ozono, el agua y el dióxido de carbono) y poliatomícas (cuentan con cuatro o más átomos, por ejemplo las moléculas de fósforo o de óxido férrico).

DE DONDE SE ORIGINAN:
Los primeros Compuestos ORGÁNICOS fueron originados y demostrados por OPARÍN y HALDANE: Admite que la atmósfera primitiva de la Tierra estaba constituída por una mezcla de gases muy rica en HIDRÓGENO y pobre en OXÍGENO. Los elementos biogenéticos, Carbono, Hidrógeno y Oxígeno, estaban combinados con el HIDRÓGENO formando METANO (CH4), AMONÍACO (NH3) y AGUA (H2O). Los compuestos mencionados, presentes en mezclas sometidas a la acción de las radiaciones ultravioletas, dieron origen a la formación de moléculas orgánicas tales como AZÚCARES y AMINOÁCIDOS. La energía necesaria para formar dichas moléculas pudo ser la radiación ultravioleta u otras formas de energía, como las descargas eléctricas, la radiactividad o el calor de las erupciones volcánicas. Se admite que este proceso debió realizarse en el agua, ya que hace 4.000 millones de años, no existía en la atmósfera la capa de ozono que filtra las radiaciones ultravioletas cuyo efecto directo sobre los seres vivos es letal. Se considera que el agua de los océanos primitivos sirvió como filtro permitiendo el desarrollo de las moléculas PREBIÓTICAS (COACERVADOS). Esta teoría de Oparín no fueron tenidas en cuenta considerando que se contradecían con lo demostrado por Pasteur acerca de la imposibilidad de originar materia orgánica a partir de la inorgánica.
UREY y MILLER: Las teorías de Oparín y Haldane fueron comprobadas por Urey y Miller que colocaron en un recipiente una mezcla de agua, amoníaco, metano e hidrógeno y la sometieron a descargas eléctricas de alto voltaje o a las radiaciones ultravioletas al mismo tiempo que hacían circular vapor de agua. Luego de un tiempo observaron en el agua la formación de aminoácidos y azúcares sencillos; se demostró de esta manera la formación de materia orgánica a partir de la inorgánica.

CANTIDAD DE COMPUESTO INORGÁNICO EN EL UNIVERSO:
Composición química de los seres vivos: C, H, O, N
Entre los principales elementos que forman el cuerpo de los seres vivos destacan cuatro, éstos son: carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N).
Estos cuatro elementos forman 97.4% del organismo de los seres vivos (carbono 9.5%, hidrógeno 63%, oxígeno 23.5% y nitrógeno 1.4%). El porcentaje restante (2.6%) lo integran los demás elementos de la tabla periódica.
Por su constitución, los compuestos pueden agruparse en dos tipos: orgánicos e inorgánicos.
Los orgánicos se caracterizan porque en su composición interviene el carbono, además de otros elementos. Los compuestos en cuya composición no aparece este elemento se llaman inorgánicos.
Hay algunas excepciones: por ejemplo, el dióxido de carbono (CO2) es un compuesto inorgánico, aunque en su composición aparezca el carbono.
Los compuestos inorgánicos que están presentes en los seres vivos son el agua y las sales minerales. Los orgánicos son los carbohidratos, los lípidos, las proteínas y los ácidos nucleicos.
Tanto las cosas como los seres vivos están formados por elementos químicos. Sin embargo, en los seres vivos la organización, la disposición y combinación de sus moléculas dan como resultado las propiedades y características por las cuales se manifiesta la vida.
Todos los seres vivos son una combinación de compuestos orgánicos e inorgánicos integrados y ordenados, de tal manera que forman la materia necesaria para que se realicen con precisión los distintos procesos funcionales que son esenciales para la vida.Compuestos inorgánicos en los seres vivos
El hidrógeno y el oxígeno se combinan entre sí para constituir el componente celular más abundante: el agua ( H2O). Más del 90% del plasma de la sangre es agua; el músculo contiene alrededor del 80% y la mayoría de los tejidos, tanto de las plantas como de los animales, contiene más del 50%. De esta manera, el agua desempeña una función importante en todas las reacciones químicas que ocurren en los seres vivos.
Por ser el componente celular más importante, el agua es un compuesto indispensable para la vida. Los nutrientes que la célula consume, el oxígeno que emplea para oxidarlos y sus propios productos de desecho son transportados por el agua. Las sales minerales están constituidas por elementos como el calcio, sodio, potasio, cloro y magnesio. Estas sustancias se encuentran en pequeñas proporciones en los organismos vivos, pero las funciones que desempeñan son de vital importancia, por ejemplo, son necesarios para que se lleven a cabo los procesos de digestión, respiración y nutrición. Como las sales son muy solubles en agua, se encuentran con facilidad en casi todos los cuerpos de los seres vivos.
La fórmula química del agua es H2O tiene dos átomos de hidrógeno y un átomo de oxígeno y una masa molar de 18 g/mol. Por medio de la electrólisis, el agua se descompone en sus elementos constituyentes (hidrógeno y oxígeno).
El agua pura es insípida, incolora e inodora, y su temperatura de ebullición es de 100º C y la de congelación de 0º C a nivel del mar.
CLASIFICACIÓN:
De acuerdo con los elementos que los forman, los compuestos químicos inorgánico se clasifican por grupos que poseen la misma característica y comportamiento. Estos grupos, llamados también funciones, están estructurados de la siguiente manera:
- Óxidos básicos
- Óxidos ácidos o anhídridos
- Hidruros
- Ácidos
- Sales
Óxidos básicos: Estos compuestos están formados por la unión de un metal y oxígeno; se encuentran comúnmente e la naturaleza, ya que se obtienen cuando un metal se pone en contacto con el oxigeno del medio ambiente, y que con el paso del tiempo se va formando óxido del metal correspondiente. Pueden prepararse industrialmente mediante la oxidación de los metales. Ejemplos: óxido de calcio, óxido plúmbico:
Metal + Oxígeno à Óxido básico
* Pb4 + O2
à PbO2
(Óxido Plúmbico)
En este caso, el calcio tiene el mismo número de oxidación que el oxigeno, 2+ y 2- respectivamente; por lo tanto, su relación es 1 a 1. Por otra parte, la molécula de todos los metales es monoatómica y la del oxigeno es diatómica; en consecuencia, se requieren dos moléculas de calcio para reaccionar con la del oxigeno y formar dos moléculas e óxido de calcio. El numero de oxidación del plomo es 4+, mientras que el de cada oxigeno es 2-; por lo tanto la relación es de un átomo de plomo por dos de oxigeno (1 a 2).
Óxidos ácidos o Anhídridos: Se forman al hacer reaccionar el oxígeno con elementos no metálicos. Como interviene el oxigeno en su formación, son también conocidos como óxidos, pero para diferenciar un óxido básico de un óxido ácido, a estos últimos se les nombra anhídridos. Ejemplos: anhídrido carbónico (oxido de carbono), anhídrido hipocloroso.
No Metal + Oxigeno à Óxido ácido
* C4 + O2 à CO2
(anhídrido carbónico)
* Cl2 + O2 (à Cl2O
(anhídrido hipocloroso)
El oxigeno y el cloro son moléculas diatómicas, es decir, formadas por dos átomos. Cada átomo de oxígeno tiene como numero de oxidación 2- y cada átomo de cloro 1+; en consecuencia, se necesitan dos átomos de cloro para unirse a un átomo de oxígeno; o bien, cuatro átomos de cloro por dos de oxígeno para formar dos moléculas de anhídrido hipocloroso.
Hidruros: Son compuestos formados de la unión del hidrogeno con elementos metálicos como el hidruro de estroncio, etc. La formación de los hidruros es el único caso en que el hidrogeno trabaja con valencia negativa. Ejemplos: hidruro de sodio, hidruro cúprico.
Metal + Hidrógeno à Hidruro
* Na+1 + H2
à NaH (hidruro de sodio)
* Cu+2 + H2 à CuH2 (hidruro cúprico)
Hidróxidos: Se caracterizan por llevar en su molécula el radical (OH-) llamado radical oxhidrilo o hidroxilo. Se forman al agregar agua a un óxido metálico. Ejemplos: hidróxido de calcio, hidróxido plúmbico:
Metal + Agua à Hidróxido
* CaO + H2O à Ca(OH-) (hidróxido de calcio)
* PbO2 + H2O à Pb(OH)4 (hidróxido plúmbico)
Ácidos: Tienen la característica de que sus moléculas inician siempre con el hidrógeno. Pueden ser:
- Hidrácidos: Se forman con el hidrógeno y un no metal. Ej.: ácido bromhídrico, ácido clorhídrico.
- Oxiácidos: Son aquellos que llevan oxígeno en su molécula además del hidrógeno y el no metal. Ej.: ácido sulfúrico, ácido nítrico.
Sales: Son compuestos que provienen de la sustitución de los hidrógenos de los ácidos por un metal, cuando reacciona un ácido con un hidróxido; por lo tanto, de los hidrácidos resultan las sales haloideas o binarias, las cuales quedan formadas por un metal y un no metal. Ej.: cloruro de sodio, sulfuro de plata:
Hidrácido + Hidróxido à Sal haloidea o binaria + Agua
De los oxiácidos pueden formarse tres tipos de sales: oxisales neutras, ácidas y complejas.
- Oxisales neutras: Se forman cuando se sustituyen totalmente los hidrógenos del ácido. Ej.: nitrato de sodio, sulfato de potasio.
- Oxisales ácidas: Se obtienen cuando la sustitución de los hidrógenos es parcial.
- Oxisales complejas: Resultan de la sustitución de los hidrógenos del ácido por dos o tres metales diferentes. Ej.: fosfato de calcio y potasio.
SUSTANCIAS INORGÁNICAS:
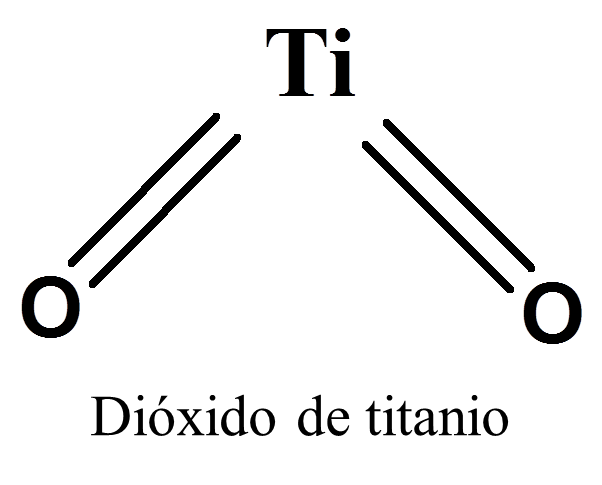
Producto - Refresco boka (Dióxido de titanio):
- Formula:
à
Ti + O2 Ti
O2
- Nombre en los tres sistemas:
PREFIJO: Dióxido de titanio
STOCK:Oxido de titanio (IV)
IUPAC: Oxido titanico
- USOS:
El dióxido de titanio se utiliza ampliamente en la industria de alimentos y productos alimenticios tales como la crema agria, requesón, helado y otros productos lácteos, que a menudo contienen el pigmento para alcanzar esa coloración blanca brillante.
El dióxido de titanio como pigmento en los productos alimenticios, se clasifica como una ayuda de proceso (o manufacturación) y no como ingrediente alimentario y, por lo tanto, puede estar exento de reflejarse en el etiquetado. Las evaluaciones de dióxido de titanio por JECFA y EFSA, han concluido que no hay problemas de seguridad asociados con el uso del dióxido de titanio, como aditivo alimentario a niveles de hasta el 3%. Esto significa que una porción de 100g de un producto lácteo puede contener hasta 3g (3000 mg) de dióxido de titanio.
El dióxido de titanio utilizado en algunos productos LAMBERTS® es un material aprobado para su uso en productos alimenticios y en productos farmacéuticos. Se considera como una sustancia no tóxica e inerte por los organismos reguladores pertinentes, ya que no se absorbe a través de la pared intestinal.
El dióxido de titanio, que recubre los comprimidos, es de un material opaco blanco y su tamaño de partícula es relativamente grande (en comparación con las nano-partículas, véase la nota a continuación) y por tanto, no se absorbe en el aparato digestivo del organismo.
Utilizamos el dióxido de titanio como recubrimiento de la tableta, para proteger los delicados nutrientes de nuestras tabletas, del daño de la luz UV y la cantidad utilizada es relativamente pequeña (generalmente 5-7mg por tableta), en comparación con la cantidad que se puede añadir a los alimentos.
La capa de dióxido de titanio también sirve como recubrimiento base de color blanco en la tableta, que nos permite dar a las pastillas un color distintivo, usando solamente pigmentos naturales, tales como la clorofila. Estos colores son requeridos como parte de nuestros estándares de control de calidad, para reducir al mínimo el riesgo remoto de que los lotes de comprimidos sean mezclados y a la vez, ayuden a nuestros clientes a identificar qué tabletas están tomando.
El dióxido de titanio como pigmento en los productos alimenticios, se clasifica como una ayuda de proceso (o manufacturación) y no como ingrediente alimentario y, por lo tanto, puede estar exento de reflejarse en el etiquetado. Las evaluaciones de dióxido de titanio por JECFA y EFSA, han concluido que no hay problemas de seguridad asociados con el uso del dióxido de titanio, como aditivo alimentario a niveles de hasta el 3%. Esto significa que una porción de 100g de un producto lácteo puede contener hasta 3g (3000 mg) de dióxido de titanio.
El dióxido de titanio utilizado en algunos productos LAMBERTS® es un material aprobado para su uso en productos alimenticios y en productos farmacéuticos. Se considera como una sustancia no tóxica e inerte por los organismos reguladores pertinentes, ya que no se absorbe a través de la pared intestinal.
El dióxido de titanio, que recubre los comprimidos, es de un material opaco blanco y su tamaño de partícula es relativamente grande (en comparación con las nano-partículas, véase la nota a continuación) y por tanto, no se absorbe en el aparato digestivo del organismo.
Utilizamos el dióxido de titanio como recubrimiento de la tableta, para proteger los delicados nutrientes de nuestras tabletas, del daño de la luz UV y la cantidad utilizada es relativamente pequeña (generalmente 5-7mg por tableta), en comparación con la cantidad que se puede añadir a los alimentos.
La capa de dióxido de titanio también sirve como recubrimiento base de color blanco en la tableta, que nos permite dar a las pastillas un color distintivo, usando solamente pigmentos naturales, tales como la clorofila. Estos colores son requeridos como parte de nuestros estándares de control de calidad, para reducir al mínimo el riesgo remoto de que los lotes de comprimidos sean mezclados y a la vez, ayuden a nuestros clientes a identificar qué tabletas están tomando.

Colorante industrial: Es uno de los materiales más blancos que existe, por lo que todas las pinturas blancas lo llevarán, puesto que con el tiempo no se degrada y mantiene ese color blanco intenso. Cualquier plástico de color blanco llevará TiO2, el papel, los juguetes así como todos los productos de decoración blancos.
Colorante dentífrico: Prácticamente todas las pastas de dientes del mercado llevan óxido de titanio entre sus ingredientes para conseguir hacer la pasta de dientes más blanca.
Colorante textil: Todas las prendas sintéticas consiguen su blanco nuclear con este material.
Construcción: El cemento blanco lleva óxido de titanio, utilizándose también de manera habitual en las cerámicas blancas y en recubrimiento del hule o linóleo.
Protector solar: Ahora que viene el verano, puedes echar un vistazo al protector solar que utilices habitualmente, ya que seguramente llevará este material, extendiéndose también su uso en jabones, polvos cosméticos y cremas.
Papel: Cualquier papel que necesite ser delgado y un blanco impoluto llevará TiO2, como los papeles especiales de la impresora o los de los cigarrillos
Fármacos: Se podrá saber que medicamentos contienen óxido de titanio entre sus ingredientes, ya que todos los fármacos que utilizan este material comparten mismos.

- DAÑOS:
Efectos del Titanio sobre la salud:
El titanio elemental y el dióxido de titanio tienen un nivel bajo de toxicidad. Animales de laboratorio (ratas) expuestos a dióxido de titanio por inhalación han desarrollado pequeñas áreas localizadas de polvo oscuro depositado en los pulmones. Una exposición excesiva en los humanos puede resultar en ligeros cambios en los pulmones.
Efectos de la sobre-exposición al polvo de titanio: La inhalación del polvo puede causar tirantez y dolor en el pecho, tos, y dificultad para respirar. El contacto con la piel y los ojos puede provocar irrritación. Vías de entrada: Inhalación, contacto con la piel, contacto con los ojos.
Carcinogenicidad: La agencia internacional para la investigación del cáncer (IARC) ha incluído el dióxido de titanio en el grupo 3 (el agente no es clasificable con respecto a su carcinogenicidad en humanos).
Efectos ambientales del Titanio:
Baja toxicidad.
No se han documentado efectos ambientales negativos del titanio.


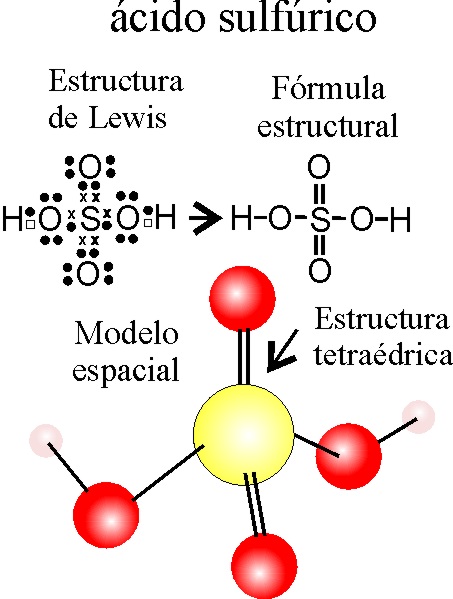
Producto - Abono (Ácido Sulfúrico):
- Formula:
SO3 + H2O à H2SO4
- Nombre en el sistema tradicional:
IUPAC: Ácido sulfúrico
- Usos:
1° Abonos: En la producción de sulfato de amonio y de superfosfatos.
2° Refino de petróleo: En la eliminación de impurezas de productos varios del petróleo, tales como gasolinas, queroseno, disolventes, etc. Si no se hiciera así, las impurezas colorearían los productos, originarían depósitos céreos en los combustibles líquidos y lubricantes, y provocarían olores desagradables.
3° Fabricación de productos químicos: En la producción de otros ácidos como el clorhídrico y el nítrico, sulfatos metálicos, carbonato de sodio y éteres.
4° Fabricación de colorantes y drogas: Obtención de productos derivados del alquitrán de hulla como colorantes, drogas y desinfectantes.
5° Decapado de acero: La superficie del acero se limpia de herrumbre sumergiéndola en un baño de ácido sulfúrico antes de recubrirlo de esmalte, estaño o cinc.
6° Metalurgia: Ciertos metales se obtienen por electrólisis de disoluciones de sus sulfatos.
7° Pinturas y pigmentos: Muchos de los pigmentos y óleos utilizados en pinturas son sulfatos.
8° Aplicaciones diversas: El ácido sulfúrico también se utiliza en la fabricación de tejidos, plásticos, explosivos, acumuladores y otros productos.


El ácido sulfúrico se mezcla con el agua y causa problemas para el medio ambiente, ya que elimina la vida vegetal. Si los organismos silvestres consumen estas aguas ácidas, pueden sufrir enfermedades o incluso morir, en algunos casos. En general, el ácido se mezcla con el agua debido al desecho inadecuado de esta sustancia, pero también puede se transmite por el aire que proviene de las fábricas. Este aire con ácido sulfúrico lo pueden inhalar los animales y los seres humanos, y puede generar el desarrollo de lluvia ácida si lo absorben las nubes de lluvia.
La naturaleza corrosiva del ácido sulfúrico causa irritación y quemaduras en la piel. Según la cantidad de ácido al que se exponga la piel, las quemaduras pueden alcanzar el tercer grado de gravedad. La exposición prolongada produce dermatitis o descamación constante e irritación de la piel. Las quemaduras generan otras infecciones, ya que la piel es la primera defensa contra las bacterias y los virus.


Producto - Jabón azul extra ( silicato de sodio ) :
H2SiO3 + Na(OH) ----> NaSiO3 + H2O


Producción de carbonato de potasio
El hidróxido de potasio, o la potasa cáustica, se usa en una variedad de aplicaciones industriales. Los usos principales son en la producción de carbonato de potasio, fosfatos de potasio, fertilizantes líquidos y jabones y detergentes de potasio. El uso singular más importante es en la producción de carbonato de potasio, el cual se usa principalmente en la fabricación de vidrios especiales, incluyendo los tubos de televisión. Otros usos del carbonato de potasio incluyen alimentos, jabones, tintes y pigmentos, compuestos de calderas, baños de galvanoplastia, extracción de dióxido de carbono de las corrientes de gas industrial, agentes deshidratantes, esmaltes de titanio, coloración en cubas e impresión de textiles, polvos para extinguidores de incendios, y el uso como sustancia química intermedia para la producción de varios productos químicos del potasio, incluyendo acetato de potasio, bisulfito, ferrocianuro, fluoruro, silicato y otros.
Producción de fosfatos de potasio
Los fosfatos, que tienen efectos de tampón, quelantes y de limpieza similares a los fosfatos de sodio, se usan en aplicaciones en donde su excelente solubilidad es valiosa y encuentran su mercado principalmente como elementos constitutivos en detergentes y limpiadores industriales, y en productos químicos para el tratamiento de aguas. Los fosfatos de potasio también se usan en productos de caseína solubilizada y en otras aplicaciones alimenticias, en anticongelantes y en fertilizantes líquidos especializados.
Producción de fertilizantes
El hidróxido de potasio se usa en la producción de fertilizantes para la agricultura. Estos fertilizantes se pueden usar como fuente de potasio (una de los tres alimentos principales para plantas) para las cosechas que son sensibles a iones de cloruro.
Producción de jabones
Los jabones de potasio incluyen aquellos hechos de ácido graso de aceite de coco, aceite vegetal, tall-oil, y ácido sulfónico de tolueno.
Otros
Otros usos finales del hidróxido de potasio incluyen la galvanoplastia, herbicidas, grasa, catalizadores, oxidantes, medicamentos y pilas alcalinas-electrolíticas. El hidróxido de potasio se usa como intermedio director para varios productos químicos del potasio, incluyen cianuro de potasio, aluminato, formato, fluosilicato, borohidruro, bromato, bromuro, gluconato, laurato, manganato, oleato y titanato.



Efecto sobre la salud
Inflamable. Nocivo por inhalación, ingestión y en contacto con la piel causa quemaduras graves, en contacto con los ojos es muy corrosivo.
El potasio puede ser encontrado en vegetales, frutas, patatas, carne, pan, leche y frutos secos. Juega un importante papel en los sistemas de fluidos físicos de los humanos y asiste en las funciones de los nervios. Cuando nuestros riñones no funcionan bien se puede dar la acumulación de potasio. Esto puede llevar a cabo una perturbación en el ritmo cardiáco.
Efectos ambientales del Potasio
Junto con el nitrógeno y el fósforo, el potasio es uno de los macronutrients esenciales para la supervivencia de las plantas. Su presencia es de gran importancia para la salud del suelo, el crecimiento de las plantas y la nutrición animal. Su función primaria en las plantas es su papel en el mantenimiento de la presión osmótica y el tamaño de la célula, influyendo de esta forma en la fotosíntesis y en la producción de energía, así como en la apertura de los estomas y el aporte de dióxido de carbono, la turgencia de la planta y la translocación de los nutrientes. Como tal, el elemento es requerido en proporciones relativamente elevadas por las plantas en desarrollo.
Las consecuencias de niveles bajos de potasio se muestran por variedad de síntomas: restricción del crecimiento, reducción del florecimiento, cosechas en los abundantes y menor calidad de producción.
Elevados niveles de potasio soluble en el agua pueden causar daños a las semillas en germinación, inhiben la toma de otros minerales y reducen la calidad del cultivo.

Bibliográfica:
http://www.definicionabc.com/general/inorganico.php
http://www.abc.com.py/articulos/como-se-forman-los-compuestos-inorganicos-oxidos-917173.html
http://www.monografias.com/trabajos14/compuestos-carbono/compuestos-carbono.shtml#ixzz3aWt1PU5G
http://www.lenntech.es/periodica/elementos/ti.htm#ixzz3aXELyV3Z
http://lambertsusa.com/art-dsp/el-uso-del-dioxido-de-titanio/#ixzz3aXCO29Jb
http://www.lenntech.es/periodica/elementos/k.htm#ixzz3aXmSYK92
El objetivo final de todo ser vivo, inclusive el hombre, es la perpetuación de la especie. Para lograrlo, deben cumplir con la función de reproducción, que consiste en la capacidad de todo ser vivo para producir otro individuo semejante, por lo que esta función se convierte en un hecho biológico trascendente, de gran importancia para la supervivencia de la especie, ya que perpetúa la vida más allá del individuo.
Cada individuo presenta al nacer características distintivas, ya que la principal función de la reproducción es transmitir, de generación en generación, el material genético: ácido desoxirribonucleico (ADN). El organismo que se produce se denomina progenitor o pariente en línea recta ascendente. El organismo procreado es el descendiente o hijo.
Generalmente se reconocen, según las especies, dos tipos de reproducción: la multiplicación vegetativa o asexual y reproducción sexual.
Es importante porque a través de esta función se garantizan la vida de las especies.

EXPLICACIÓN DEL VÍDEO:
Este vídeo trata sobre la reproducción en lo seres vivos, nos explican que es, como se divide (en reproducción sexual y asexual) y en que consiste cada una y en que seres vivos se ven o realizan estos tipos de reproducción y su importancia.
Diapositivas sobre la reproducción:
Bibliográfica:
http://recursostic.educacion.es/newton/web/materiales_didacticos/EDAD_2eso_10_reproduccion/2quincena10/2quincena10_contenidos_2a.htm
5° Decapado de acero: La superficie del acero se limpia de herrumbre sumergiéndola en un baño de ácido sulfúrico antes de recubrirlo de esmalte, estaño o cinc.
6° Metalurgia: Ciertos metales se obtienen por electrólisis de disoluciones de sus sulfatos.
7° Pinturas y pigmentos: Muchos de los pigmentos y óleos utilizados en pinturas son sulfatos.
8° Aplicaciones diversas: El ácido sulfúrico también se utiliza en la fabricación de tejidos, plásticos, explosivos, acumuladores y otros productos.


- Daños:
El ácido sulfúrico se mezcla con el agua y causa problemas para el medio ambiente, ya que elimina la vida vegetal. Si los organismos silvestres consumen estas aguas ácidas, pueden sufrir enfermedades o incluso morir, en algunos casos. En general, el ácido se mezcla con el agua debido al desecho inadecuado de esta sustancia, pero también puede se transmite por el aire que proviene de las fábricas. Este aire con ácido sulfúrico lo pueden inhalar los animales y los seres humanos, y puede generar el desarrollo de lluvia ácida si lo absorben las nubes de lluvia.
La naturaleza corrosiva del ácido sulfúrico causa irritación y quemaduras en la piel. Según la cantidad de ácido al que se exponga la piel, las quemaduras pueden alcanzar el tercer grado de gravedad. La exposición prolongada produce dermatitis o descamación constante e irritación de la piel. Las quemaduras generan otras infecciones, ya que la piel es la primera defensa contra las bacterias y los virus.


Producto - Jabón azul extra ( silicato de sodio ) :
- Formula:
H2SiO3 + Na(OH) ----> NaSiO3 + H2O
Acido silicico hidróxido de sodio
silicato de sodio
(Si
O)-1
Ion
silicato
- usos:
Los silicatos de sodio tienen diferentes usos industriales, debido a que sus componentes (óxido de sodio y óxido de silicio) actúan conjuntamente, situación que no presentan la mayoría de los álcalis.
La variedad de relaciones con las que se fabrican los silicatos de sodio, así como la diversidad en densidades, permiten su aplicación en diferentes usos y aplicaciones como son:
Jabón de lavandería:
Los silicatos de sodio han desplazado a las resinas como la colofonia, rosina, etc., en la elaboración de jabones. Situación que surgió en un principio debido a la escasez y al alto costo de las resinas saponificables. Posteriormente el uso de los silicatos se generalizó en virtud de que los investigadores encontraron diversas ventajas atribuibles al silicato en las nuevas formulaciones.
Detergentes:
En los detergentes el silicato de sodio tiene una participación activa en las propiedades de los mismos, por lo que éste forma una capa protectora sobre la superficie del metal que ayuda a prevenir la corrosión de los metales.
Adhesivos:Los silicatos de sodio poseen características que los hacen funcionar por sí mismos como adhesivos y estos humectan rápidamente los vidrios, superficies cerámicas, asbestos, mica, fibras de celulosa, lana sintética, pelo, nylon, madera no resinosa y la mayoría de los minerales como: acero, aluminio, zinc, plomo y algunas otras superficies metálicas.
Morteros refractarios:
El uso de los silicatos de sodio en esta rama industrial se debe a que la completa deshidratación de las soluciones de silicato ocurre a altas temperaturas, generalmente en el rango de 1000-1100 °C.
La variedad de relaciones con las que se fabrican los silicatos de sodio, así como la diversidad en densidades, permiten su aplicación en diferentes usos y aplicaciones como son:
Jabón de lavandería:
Los silicatos de sodio han desplazado a las resinas como la colofonia, rosina, etc., en la elaboración de jabones. Situación que surgió en un principio debido a la escasez y al alto costo de las resinas saponificables. Posteriormente el uso de los silicatos se generalizó en virtud de que los investigadores encontraron diversas ventajas atribuibles al silicato en las nuevas formulaciones.
Detergentes:
En los detergentes el silicato de sodio tiene una participación activa en las propiedades de los mismos, por lo que éste forma una capa protectora sobre la superficie del metal que ayuda a prevenir la corrosión de los metales.
Adhesivos:Los silicatos de sodio poseen características que los hacen funcionar por sí mismos como adhesivos y estos humectan rápidamente los vidrios, superficies cerámicas, asbestos, mica, fibras de celulosa, lana sintética, pelo, nylon, madera no resinosa y la mayoría de los minerales como: acero, aluminio, zinc, plomo y algunas otras superficies metálicas.
Morteros refractarios:
El uso de los silicatos de sodio en esta rama industrial se debe a que la completa deshidratación de las soluciones de silicato ocurre a altas temperaturas, generalmente en el rango de 1000-1100 °C.


Producto - Loción crema para el cuerpo (hidróxido de potacio):
- Formula:
- Nombre en los tres sistemas:
PREFIJO: Monohidroxido de potacio
STOCK: Hidróxido de potacio (I)
IUPAC: Hidróxido de potacio
- Usos:
El hidróxido de potasio, o la potasa cáustica, se usa en una variedad de aplicaciones industriales. Los usos principales son en la producción de carbonato de potasio, fosfatos de potasio, fertilizantes líquidos y jabones y detergentes de potasio. El uso singular más importante es en la producción de carbonato de potasio, el cual se usa principalmente en la fabricación de vidrios especiales, incluyendo los tubos de televisión. Otros usos del carbonato de potasio incluyen alimentos, jabones, tintes y pigmentos, compuestos de calderas, baños de galvanoplastia, extracción de dióxido de carbono de las corrientes de gas industrial, agentes deshidratantes, esmaltes de titanio, coloración en cubas e impresión de textiles, polvos para extinguidores de incendios, y el uso como sustancia química intermedia para la producción de varios productos químicos del potasio, incluyendo acetato de potasio, bisulfito, ferrocianuro, fluoruro, silicato y otros.
Producción de fosfatos de potasio
Los fosfatos, que tienen efectos de tampón, quelantes y de limpieza similares a los fosfatos de sodio, se usan en aplicaciones en donde su excelente solubilidad es valiosa y encuentran su mercado principalmente como elementos constitutivos en detergentes y limpiadores industriales, y en productos químicos para el tratamiento de aguas. Los fosfatos de potasio también se usan en productos de caseína solubilizada y en otras aplicaciones alimenticias, en anticongelantes y en fertilizantes líquidos especializados.
Producción de fertilizantes
El hidróxido de potasio se usa en la producción de fertilizantes para la agricultura. Estos fertilizantes se pueden usar como fuente de potasio (una de los tres alimentos principales para plantas) para las cosechas que son sensibles a iones de cloruro.
Producción de jabones
Los jabones de potasio incluyen aquellos hechos de ácido graso de aceite de coco, aceite vegetal, tall-oil, y ácido sulfónico de tolueno.
Otros
Otros usos finales del hidróxido de potasio incluyen la galvanoplastia, herbicidas, grasa, catalizadores, oxidantes, medicamentos y pilas alcalinas-electrolíticas. El hidróxido de potasio se usa como intermedio director para varios productos químicos del potasio, incluyen cianuro de potasio, aluminato, formato, fluosilicato, borohidruro, bromato, bromuro, gluconato, laurato, manganato, oleato y titanato.


- Usos:

Efecto sobre la salud
Inflamable. Nocivo por inhalación, ingestión y en contacto con la piel causa quemaduras graves, en contacto con los ojos es muy corrosivo.
El potasio puede ser encontrado en vegetales, frutas, patatas, carne, pan, leche y frutos secos. Juega un importante papel en los sistemas de fluidos físicos de los humanos y asiste en las funciones de los nervios. Cuando nuestros riñones no funcionan bien se puede dar la acumulación de potasio. Esto puede llevar a cabo una perturbación en el ritmo cardiáco.
Efectos ambientales del Potasio
Junto con el nitrógeno y el fósforo, el potasio es uno de los macronutrients esenciales para la supervivencia de las plantas. Su presencia es de gran importancia para la salud del suelo, el crecimiento de las plantas y la nutrición animal. Su función primaria en las plantas es su papel en el mantenimiento de la presión osmótica y el tamaño de la célula, influyendo de esta forma en la fotosíntesis y en la producción de energía, así como en la apertura de los estomas y el aporte de dióxido de carbono, la turgencia de la planta y la translocación de los nutrientes. Como tal, el elemento es requerido en proporciones relativamente elevadas por las plantas en desarrollo.
Las consecuencias de niveles bajos de potasio se muestran por variedad de síntomas: restricción del crecimiento, reducción del florecimiento, cosechas en los abundantes y menor calidad de producción.
Elevados niveles de potasio soluble en el agua pueden causar daños a las semillas en germinación, inhiben la toma de otros minerales y reducen la calidad del cultivo.
Bibliográfica:
http://www.definicionabc.com/general/inorganico.php
http://www.abc.com.py/articulos/como-se-forman-los-compuestos-inorganicos-oxidos-917173.html
http://www.monografias.com/trabajos14/compuestos-carbono/compuestos-carbono.shtml#ixzz3aWt1PU5G
http://www.lenntech.es/periodica/elementos/ti.htm#ixzz3aXELyV3Z
http://lambertsusa.com/art-dsp/el-uso-del-dioxido-de-titanio/#ixzz3aXCO29Jb
http://www.lenntech.es/periodica/elementos/k.htm#ixzz3aXmSYK92
REPRODUCCIÓN DE LOS SERES VIVOS
ÁREA: BIOLOGÍA
INTRODUCCIÓN
El objetivo final de todo ser vivo, inclusive el hombre, es la perpetuación de la especie. Para lograrlo, deben cumplir con la función de reproducción, que consiste en la capacidad de todo ser vivo para producir otro individuo semejante, por lo que esta función se convierte en un hecho biológico trascendente, de gran importancia para la supervivencia de la especie, ya que perpetúa la vida más allá del individuo.
Cada individuo presenta al nacer características distintivas, ya que la principal función de la reproducción es transmitir, de generación en generación, el material genético: ácido desoxirribonucleico (ADN). El organismo que se produce se denomina progenitor o pariente en línea recta ascendente. El organismo procreado es el descendiente o hijo.
Generalmente se reconocen, según las especies, dos tipos de reproducción: la multiplicación vegetativa o asexual y reproducción sexual.
Es importante porque a través de esta función se garantizan la vida de las especies.

EXPLICACIÓN DEL VÍDEO:
Este vídeo trata sobre la reproducción en lo seres vivos, nos explican que es, como se divide (en reproducción sexual y asexual) y en que consiste cada una y en que seres vivos se ven o realizan estos tipos de reproducción y su importancia.
Diapositivas sobre la reproducción:
Bibliográfica:
http://recursostic.educacion.es/newton/web/materiales_didacticos/EDAD_2eso_10_reproduccion/2quincena10/2quincena10_contenidos_2a.htm
http://www.biologia.edu.ar/botanica/tema22/tema22-6repr.htm
Elaborado por: Cindy Paola García Serna 11°4